Hydrogen Peroxide là hoá chất quen thuộc thường gặp trong xử lý vết thương hàng ngày. Ngoài ra đây cũng là hóa chất được ứng dụng phổ biến trong quá trình xử lý nước bể bơi. Cùng tìm hiểu thông tin chi tiết về đặc điểm và công dụng của hóa chất Hydrogen Peroxide trong bài viết sau:
Hydrogen Peroxide là gì?
Hydrogen Peroxide hay còn gọi là oxy già (H2O2) được phát hiện bởi một nhà khoa học người Nga vào năm 1882 và đã mang lại giải Nobel năm 1908. Chất này tồn tại tự nhiên trong cơ thể con người được tạo ra bởi các túi lysosome của bạch cầu và đóng vai trò quan trọng trong hệ miễn dịch.

Hydrogen Peroxide giúp cơ thể tiêu diệt vi khuẩn, khử trùng và ngăn chặn sự xâm nhập của các tác nhân có hại từ bên ngoài. Hydrogen Peroxide có các đặc điểm, tính chất và công thức hóa học tương tự như oxy già. Bên cạnh đó còn được biết đến với một số tên gọi khác như Hydroperoxide và hydro điôxít.
Những tính chất đặc trưng của oxy già Hydrogen Peroxide
Những tính chất đặc trưng của Hydrogen Peroxide mà bạn nên nắm rõ khi có nhu cầu sử dụng hoá chất này như sau:
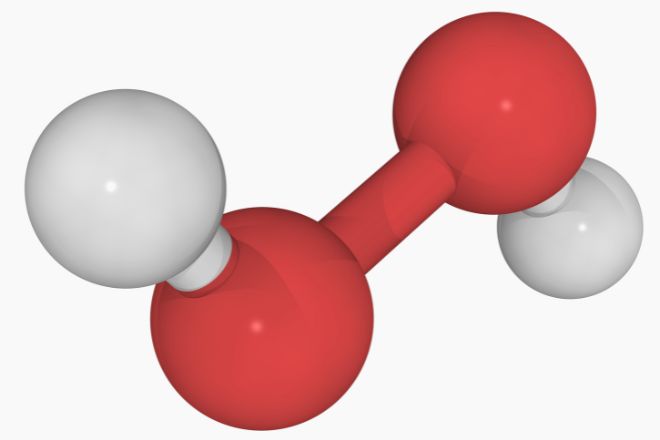
Tính chất vật lý
Hydrogen Peroxide (H2O2) là một hợp chất lỏng không màu với mùi hắc đặc trưng. Ở nhiệt độ 30°C, hoá chất này có áp suất hóa hơi và hoàn toàn hòa tan trong nước. Với tỷ trọng 1,4 g/cm³ trong trạng thái lỏng, hydrogen peroxide cũng có khả năng hòa tan trong một số dung môi cụ thể. Điểm nóng chảy là -11°C (12°F; 262 K) và điểm sôi là 141°C (286°F; 414 K). Giá trị pKa của hydrogen peroxide là 11,65 và độ nhớt của nó đạt 1,245 cP ở 20°C.
Phân tử hydrogen peroxide có hình dạng “xiên lệch” do sự đẩy giữa các cặp điện tử đơn trên các nguyên tử oxy. Mặc dù liên kết O-O chỉ là một liên kết đơn, nhưng rào cản để phân tử thực hiện vòng quay hoàn toàn cao tới 29,45 kJ/mol, do lực đẩy giữa các cặp điện tử đơn.
Các góc liên kết trong phân tử hydrogen peroxide chịu ảnh hưởng lớn từ liên kết hydro, gây ra sự khác biệt giữa các dạng hơi và tinh thể. Các góc liên kết trong tinh thể chứa H2O2 có thể dao động trong một phạm vi rộng.
Tính chất hóa học
Ngoài tính chất vật lý trên thì hoá chất Hydrogen Peroxide còn sở hữu những tính chất hoá học khác như:
Hydrogen Peroxide là axit hay bazơ
H2O2 là một axit yếu với pH khoảng 4,5 có khả năng tạo ra muối hydroperoxit hoặc peroxit cùng với các dẫn xuất kim loại thông qua phản ứng với các anion.
Na2B4O7 + 4H2O2 + 2NaOH → 2Na2B2O4(OH)4 + H2O
Đồng thời, H2O2 là một bazơ yếu hơn cả nước nhưng vẫn có khả năng phản ứng với các axit mạnh để tạo ra một số hợp chất.
Tính phân hủy
Hydrogen peroxide là chất dễ phân hủy tự nhiên chuyển hóa thành nước và oxy. Hoá chất này thường được dùng như chất oxy hóa, nhưng trong một số phản ứng cũng có thể đóng vai trò là chất khử. Quá trình phân hủy tỏa nhiệt tự nhiên của H2O2 được biểu diễn như sau:
2 H2O2 → 2 H2O + O2 + Nhiệt lượng
Tốc độ phân hủy của hydrogen peroxide phụ thuộc vào nhiệt độ, nồng độ, pH và sự có mặt của chất ổn định hoặc tạp chất. Đặc biệt hoá chất này có thể bị kích hoạt bởi các kim loại chuyển tiếp.
Tạo hợp chất peroxide
Các phản ứng tạo thành hợp chất peroxide liên quan đến nhóm O-O, gọi là nhóm peroxide hoặc peroxo. Ví dụ, H2O2 có thể oxy hóa axit cacboxylic (RCOOH) thành axit peroxy (RCOOOH), tác dụng với axeton để tạo axeton peroxit hoặc phản ứng với ozon để tạo hydro trioxit.
Khi tác dụng với ure, hydrogen peroxide tạo ra carbamide peroxit, một chất dùng trong làm trắng răng. Các phản ứng này thường có tính oxy hóa mạnh nên cần thận trọng khi sử dụng để tránh các ảnh hưởng đến sức khoẻ và môi trường xung quanh.
Phản ứng với Oxy hóa khử
Trong dung dịch nước, hydrogen peroxide có thể phản ứng như chất oxy hóa hoặc chất khử với nhiều ion vô cơ. Ví dụ, trong dung dịch axit, H2O2 oxy hóa ion Fe²⁺ thành Fe³⁺:
2Fe2+(dung dịch) + H2O2 + 2H+(dung dịch) → 2Fe3+(dung dịch) + 2H2O(lỏng)
Sunfit (SO₃²⁻) sẽ bị oxy hóa thành sunfat (SO₄²⁻), còn kali permanganat bị khử thành mangan(II) (Mn²⁺). Trong môi trường kiềm, một số phản ứng này sẽ xảy ra theo chiều ngược lại; Mn²⁺ bị oxy hóa thành Mn⁴⁺ (MnO₂), và Fe³⁺ bị khử thành Fe²⁺. H2O2 cũng được dùng làm chất khử trong hóa học hữu cơ, ví dụ để oxy hóa thành sulfoxit, hoặc epoxit hóa alken.
Công dụng của Hydrogen Peroxide như thế nào?
Ngoài việc được sử dụng để sát khuẩn vết thương, oxy già Hydrogen Peroxide còn nổi tiếng với nhiều công dụng tuyệt vời trong các lĩnh vực khác nhau như: mỹ phẩm làm đẹp, hóa chất xử lý nước bể bơi, công nghiệp tẩy trắng và nhiều ứng dụng khác như

Hóa chất khử trùng bể bơi
Với nồng độ từ 35% đến 50%, Hydrogen Peroxide có khả năng oxy hóa rất mạnh. Khi kết hợp với chiếu sáng tia UV, hoá chất này tạo ra các gốc oxy tự do giúp khử trùng nước bể bơi một cách an toàn và tiết kiệm. Đây là phương pháp được nhiều chủ hồ bơi và doanh nghiệp kinh doanh trong lĩnh vực này ưa chuộng.
Đặc biệt, H2O2 còn có khả năng trung hòa lượng clo dư trong nước hồ bơi. Nếu bạn vô tình sử dụng quá nhiều hóa chất như chlorine 70 hoặc viên sủi TCCA 90, Hydrogen Peroxide đậm đặc có thể giúp khắc phục tình trạng này hiệu quả.
Trong làm đẹp thẩm mỹ
Hydrogen Peroxide với nồng độ thấp được biết đến với tính năng khử trùng và diệt khuẩn tốt nên cũng được ứng dụng trong lĩnh vực thẩm mỹ và chăm sóc sắc đẹp:
- Trị mụn trứng cá: Với đặc tính kháng khuẩn và làm dịu da, bạn có thể nhỏ 1-2 giọt oxy già lên đầu bông tăm và chấm nhẹ vào nốt mụn (lưu ý tránh tiếp xúc với vùng da lành để tránh kích ứng).
- Làm trắng răng an toàn: Hòa oxy già với nước theo tỷ lệ 1:1 để tạo dung dịch súc miệng sau khi đánh răng. Thực hiện đều đặn sẽ giúp cải thiện màu sắc và làm trắng răng dần theo thời gian.
- Giữ màu tóc nhuộm bóng mượt: Để màu tóc nhuộm bền màu và bóng tự nhiên, bạn có thể xịt dung dịch oxy già pha loãng lên tóc sau khi gội.
Trong công nghiệp
Khoảng 50% sản lượng Hydrogen Peroxide trên thế giới được dùng trong công nghiệp tẩy trắng giấy và bột giấy và là thành phần chính trong sản xuất natri percacbonat và natri perborat – hai chất tẩy rửa nhẹ trong bột giặt. Ngoài ra, khả năng phân hủy mạnh mẽ của H2O2 tạo ra nhiều oxy giúp nó trở thành chất đẩy trong động cơ tên lửa.
Công dụng khác
Oxy già còn có nhiều lợi ích hấp dẫn khác như: ngâm rửa rau củ quả để loại bỏ vi khuẩn và hóa chất độc hại, tắm thải độc, ngâm chân để khử mùi và khử nấm mốc, tẩy trắng quần áo và diệt côn trùng như bọ và rận trong chăn gối. Hydrogen Peroxide là một chất hóa học đa năng với nhiều ứng dụng thú vị trong đời sống hàng ngày và công nghiệp.
Hướng dẫn phương pháp điều chế H2O2 Hydrogen Peroxide
Có nhiều phương pháp để điều chế Hydrogen Peroxide nhưng phương pháp chính và phổ biến nhất là quá trình Anthraquinone. Quá trình này diễn ra qua các bước sau:

- Bước 1: Tạo chất xúc tác Hydrogenation: Các hợp chất mangan và cobalt được trộn lẫn để tạo thành hỗn hợp hydroxide. Hỗn hợp này sau đó được nung nóng ở khoảng 500°C trong một lò đặc biệt để tạo ra chất xúc tác cần thiết cho quá trình hydrogen hóa.
- Bước 2: Tách chiết Anthraquinone từ dầu mỏ: Các hợp chất như Anthracene và Phthalic Anhydride được hòa tan trong nhựa đường (molasses) để tạo thành một hỗn hợp. Hỗn hợp này sau đó trải qua nhiều giai đoạn chưng cất để tách chiết Anthraquinone ra khỏi các thành phần khác.
- Bước 3: Quá trình Hydrogen hóa: Anthraquinone được đưa vào một bình chứa cùng với khí Hydrogen và chất xúc tác đã chuẩn bị từ bước 1. Quá trình này chuyển hóa Anthraquinone thành Hydrogen Peroxide và nước.
- Bước 4: Tách chiết Hydrogen Peroxide: Hydrogen Peroxide và nước được tách ra dựa trên sự khác biệt về tính chất phân cực của chúng. Hydrogen Peroxide sau đó được lọc và tinh chế thêm để loại bỏ các tạp chất còn lại.
Quá trình Anthraquinone để sản xuất Hydrogen Peroxide là một quy trình phức tạp, đòi hỏi phải được thực hiện bởi các chuyên gia có kinh nghiệm với các hóa chất. Vì vậy bạn cần tuân thủ nghiêm ngặt các quy trình an toàn và các quy định pháp luật để đảm bảo an toàn và chất lượng sản phẩm.
Trên đây là thông tin chi tiết về hoá chất Hydrogen Peroxide bao gồm tính chất, công dụng và phương pháp điều chế. Nếu bạn có nhu cầu mua hoá chất này thì hãy liên hệ với Bể Bơi Toàn Cầu để nhận được báo giá tốt nhất.
